
Rastreamento de Cargas
(*) Quando o remetente ou o destinatario for pessoa fisica, adicionar "000" (3 zeros) antes do numero do CPF.

(*) Quando o remetente ou o destinatario for pessoa fisica, adicionar "000" (3 zeros) antes do numero do CPF.

04 de novembro de 2021
Quem trabalha em laboratório de análises sabe: é preciso conhecer todos os detalhes das substâncias. Dessa forma, é possível assegurar a qualidade dos produtos comercializados, principalmente nos casos dos setores alimentício e farmacêutico. É aqui que a medição de pH ganha seu merecido destaque.
Definir se o pH da amostra é ácido, neutro ou alcalino é parte essencial desse processo. Sendo assim, não cometer erros durante a medição é crucial para evitar o retrabalho.
Cansou de falhas e imprecisões em suas análises? Saiba como realizar medições impecáveis com as técnicas que reunimos neste artigo, além de ganhar uma refrescada na memória sobre a importância do pH na constituição dos produtos. Vamos lá?
Antes de mais nada: você sabe o que é um átomo? Segundo o dicionário Oxford Languages, átomo é um “sistema energético estável, eletricamente neutro, que consiste em um núcleo denso carregado, envolvido por elétrons”.
Todo elemento químico é constituído por átomos, que ao se agruparem formam moléculas. Em suma, a fórmula molecular é o que ajuda a identificar qual é a composição de átomos de uma molécula em específico. Por exemplo, a fórmula da água: ela é composta por dois átomos de hidrogênio e um de oxigênio (H2O).
Ou seja, quando “se quebra” a molécula da água libera quantidades iguais de íons H+ (hidrogênio) e OH- (hidroxila), o que faz dela uma substância neutra. Do mesmo modo, a dissociação não ocorre apenas com a água: as moléculas dos ácidos e das bases também podem “se quebrar”.
Desse modo, se uma substância, quando está em contato com o meio aquoso, libera mais íons H+ do que OH-, ela é classificada como ácida. Similarmente o contrário também ocorre: se são liberados mais íons OH-, a substância é considerada básica ou alcalina.
Em conclusão, a escala de pH é a medição do potencial de hidrogênio: vai de 0 a 14, com o 7 considerado neutro (a água é usada como referência). Quanto maior o potencial de hidrogênio, mais ácida é a substância (em tons que vão de amarelo ao vermelho). Quanto menor o potencial de hidrogênio, mais básica/alcalina é a substância (em tons que vão de verde ao roxo). Veja na imagem abaixo:

É possível saber qual é o pH exato de uma substância utilizando um pHmetro, equipamento que mede o potencial de hidrogênio. Foi inventado em 1934 pelo químico estadunidense Arnold Orville Beckman.
Acima de tudo, o que proporciona a mágica da medição é o eletrodo. Conectado a um circuito potenciômetro, ele produz milivolts quando submerso na amostra, ao passo que são convertidos em unidades de pH depois. Para ter resultados mais precisos é necessário calibrar o eletrodo antes de usar o pHmetro.
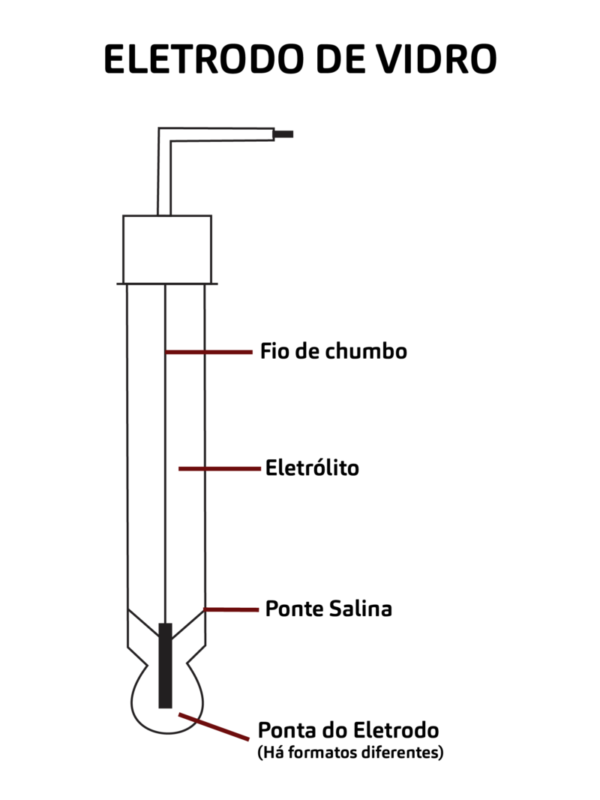
Por fim, para analisar a amostra, a ponta do eletrodo deve ser imersa completamente na substância, ultrapassando a ponte salina e atingindo o corpo de vidro seco. É possível inserir todo o eletrodo na amostra, se preciso, sempre respeitando o nível máximo apontado no manual do produto.
Agora que esclarecemos a importância do pH e como o eletrodo é o responsável pela medição, seguem nossas dicas para a conservação e utilização do equipamento. Como resultado, você não terá mais problemas ao usar o pHmetro e garantirá medições precisas, sobretudo eliminando o retrabalho. Dê uma olhada abaixo:
Conforme o esclarecido nos parágrafos anteriores, o eletrodo é a parte mais importante do processo de medição. É o componente que lê os resultados do pH. Suas camadas hidratadas são sensíveis e precisam de muito cuidado durante o manuseio e armazenamento. Desde já, tome notas para manter a saúde do seu eletrodo:
Por vezes, dependendo da substância que terá o pH medido, é preciso usar outro tipo de eletrodo. Há três tipos disponíveis no mercado, cada um com suas diferenças:
Portanto, não desperdice tempo e garanta a medição objetiva da sua análise escolhendo o eletrodo adequado.
É necessário calibrar o pHmetro antes de realizar qualquer medição, para garantir a leitura precisa do nível de pH da substância analisada. A calibração determina a inclinação e o deslocamento do eletrodo e registra as informações no indicador do equipamento.
O ideal é calibrar o pHmetro todos os dias. Se não for possível, há a opção de realizar o procedimento duas vezes por semana. Desse jeito você otimiza o tempo para realizar medições mais rápidas. Quanto maior a frequência de calibração, mais precisa é a medição do equipamento.
Este post foi útil? Então dê uma olhada no site da Cap-Lab, onde você encontra mais informações e artigos para laboratório! Entre em contato com o nosso Departamento de Vendas em vendas@cap-lab.com.br.
TOP 10 Erros na Medição de pH. Hanna Instruments, 2019. Disponível em: https://hannainst.com.br/top-10-erros-na-medicao-de-ph/. Acesso em: 22 set. 2021.
CONCEITO de pH. Manual da Química, c2021. Disponível em: https://www.manualdaquimica.com/fisico-quimica/conceito-ph.htm. Acesso em: 23 set. 2021.
COMO o pHmetro foi inventado?. Clube da Química, c2021. Disponível em: https://clubedaquimica.com/2021/03/28/como-o-phmetro-foi-inventado/. Acesso em: 23 set. 2021.
POR QUE a Química me interessa?. Introdução às Bases, ácidos e escala de pH. Youtube, 11 jan. 2021. Disponível em: https://www.youtube.com/watch?v=QeqiRHJpY0s. Acesso em: 23 set. 2021.
COLTEC Tube. #Química – Medindo pH com pHmetro. Youtube, 23 out. 2016. Disponível em: https://www.youtube.com/watch?v=zosqquhAQx0A. Acesso em: 24 set. 2021.
Voltar